近日,我所生物分子功能与机制研究组(1821组)朴海龙研究员团队在分泌多效生长因子Midkine的功能研究方面取得新进展。研究团队发现分泌生长因子Midkine可以不通过配体的方式在细胞内发挥功能的非经典作用途径,阐明了Midkine在细胞内通过蛋白互作的方式抑制LKB1-AMPK通路活性的新机制,揭示了Midkine可以通过抑制LKB1-AMPK通路来促进肿瘤细胞增殖和肿瘤形成的新功能,为进一步研究Midkine的临床转化应用提供了新思路。
生长因子对生理活动具有着重要的调节作用,分泌到细胞外是其最常见的作用方式。生长因子作为配体,可以通过结合细胞膜上的特异受体来激活细胞内的信号通路。而Midkine是生长因子的重要种类之一,在发育、损伤修复、血压调控、炎症免疫反应等过程中发挥着重要作用,并在多种癌症中具备高表达的特性。细胞外的Midkine可与多种细胞膜上的受体蛋白相结合,但是由于其亲和性较低,不足以解释Midkine的全部功能。目前,虽然有研究证明细胞外的Midkine蛋白可以通过胞吞作用进入细胞内部并进入细胞核,但对Midkine在细胞内的功能研究鲜有报道。
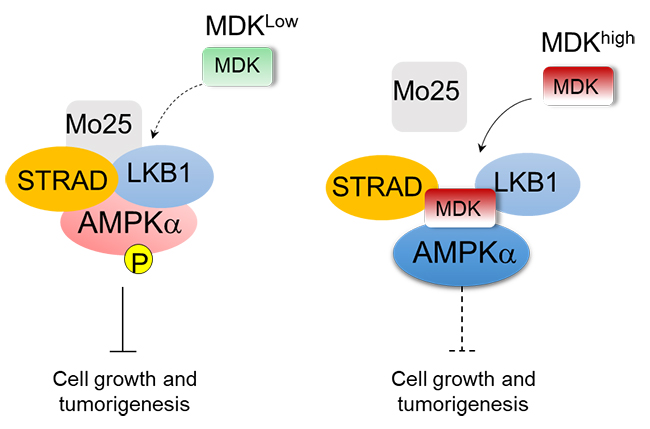
本工作中,研究人员发现细胞外的Midkine蛋白可以高效地转运进入细胞内,并定位于细胞质中,暗示了Midkine在细胞质中发挥着重要的作用。通过基于大数据的通路富集分析,研究人员首次发现Midkine与AMPK通路具有密切的相关性。随后,通过生物化学和细胞生物学实验证明Midkine抑制了AMPK的磷酸化激活。值得注意的是,阻止Midkine进入细胞可以解除其对AMPK的抑制作用。这一发现证明了Midkine对AMPK的抑制作用是发生于细胞内部的,证实了Midkine蛋白具有重要的胞内功能。
此外,团队进一步探索了Midkine抑制AMPK的分子机制,确认了Midkine可以通过AMPK的上游激酶LKB1来调控AMPK的活性。一般情况下,LKB1通过与STRAD和Mo25形成异源三聚体,从而发生多位点自磷酸化并进行激活。而本工作中,研究人员发现Midkine可以直接结合LKB1和STRAD蛋白,从而抑制LKB1-STRAD-Mo25蛋白复合体的形成,进而抑制了AMPK的激活。研究人员进一步通过基因编辑手段及细胞生物学实验发现,通过Midkine调控LKB1-AMPK通路后能够促进癌症细胞增殖。临床数据分析显示,Midkine表达水平与AMPK的活性及病人生存率呈现负相关,证明了Midkine通过抑制LKB1-AMPK通路促进癌症的发展。本工作为全面解析Midkine的功能提供了新方向,也为Midkine的临床转化应用提供了新思路。
相关研究成果以“Midkine Noncanonically Suppresses AMPK Activation through Disrupting the LKB1-STRAD-Mo25 Complex”为题,于近日发表于Cell Death and Disease上。该工作的第一作者是我所1821组助理研究员夏天。该工作获得了国家自然科学基金、大连市科技创新基金、我所创新基金等项目的支持。(文/图 夏天)