近日,我所生物分离分析新材料与新技术研究组(1809组)叶明亮研究员、秦洪强研究员团队与中科院上海药物所黄蔚研究员团队合作,提出并构建了O-乙酰氨基葡萄糖(O-GlcNAc)糖肽的可逆酶促化学标记策略,并与亲水作用色谱富集方法相结合,实现了O-GlcNAc糖基化的高灵敏度检测,为生物样品中蛋白质O-GlcNAc糖基化的高覆盖度检测提供了一种简便有效的手段。
O-GlcNAc修饰主要发生在丝氨酸或苏氨酸(Ser/Thr)的残基,是一种重要的蛋白质翻译后修饰(PTM),参与调控细胞代谢、信号转导、免疫应答等生理过程。由于O-GlcNAc的低丰度、高度动态变化性,极大地增加了富集与分析的难度。目前,现有的抗体等非共价作用富集策略存在亲和力低、富集效率低等问题;化学酶促标记法等富集策略虽然显著提高了糖肽富集的特异性,但是该策略引入大质量标签,降低了糖肽的鉴定效率。
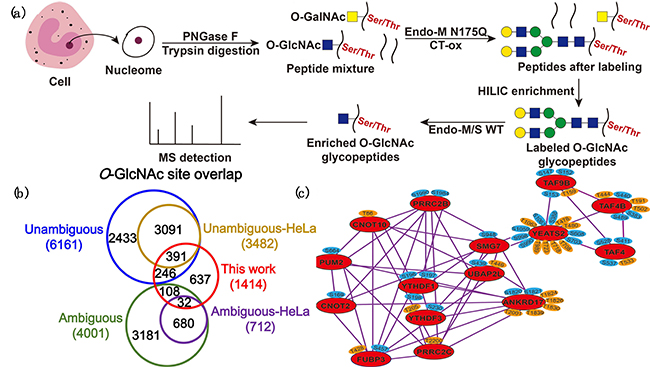
针对上述问题,合作团队发展了一种可逆标记的无损富集检测策略。在该策略中,科研人员首先利用糖苷内切酶突变体Endo-M N175Q的转糖酶连接活性,将N-糖链基团连接到O-GlcNAc糖单元,从而提高O-GlcNAc糖肽的亲水性;接着,基于延长糖链的亲水性,采用亲水作用色谱方法对O-GlcNAc标记糖肽进行富集;最后,利用野生型糖苷内切酶Endo-M/S的水解活性,将富集后糖肽中的标记糖链释放,实现O-GlcNAc糖肽的无痕富集,避免了标记糖链对O-GlcNAc糖肽鉴定效率的影响,以此实现了O-GlcNAc糖肽的无损富集与检测。
合作团队将该方法应用于HeLa细胞核蛋白质O-GlcNAc糖基化的分析,从1.1mg蛋白样品中共鉴定到1414处潜在O-GlcNAc糖基化位点,其中637处(约45%)未在人源O-GlcNAc糖基化数据库中收录(1985-2020年),丰富了O-GlcNAc糖蛋白组基础数据。本工作鉴定到的O-GlcNAc糖蛋白中,包括识别RNA上N6-甲基腺苷(m6A)的YTHDF1和YTHDF3蛋白,以及与之形成相互作用网络的另外13种蛋白,后者与剧烈条件下应激小体的形成密切相关,为应激小体形成与蛋白质O-GlcNAc之间的作用机制研究提供了新线索。
相关研究成果以“Endo-M Mediated Chemoenzymatic Approach Enables Reversible Glycopeptide Labeling for O-GlcNAcylation Analysis”为题,发表在《德国应用化学》(Angew. Chem. Int. Ed.)上。该工作的共同第一作者是我所1809组博士研究生陈尧和中科院上海药物所唐峰博士。上述工作得到国家自然科学基金、国家重点研发计划、我所创新基金、中科院青促会等项目的资助。(文/图 秦洪强)