近日,我所蛋白质折叠化学生物学创新特区研究组(02T5组)刘宇研究员团队和大连医科大学附属第二医院高占明教授团队合作,基于多色相变蛋白质荧光探针发展了双光热迁移分析法,实现了对两种不同蛋白质共聚集过程的实时监控与分析,定量解析了多重致病蛋白质共沉积的作用机制。
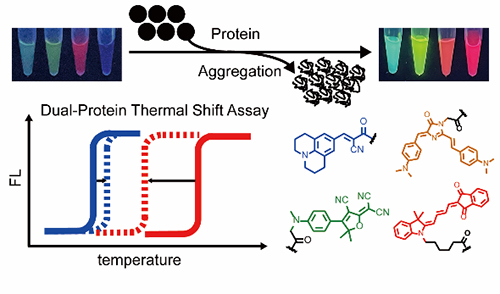
蛋白质在人体内的相变过程会诱发多种退行性疾病,例如阿尔兹海默症、渐冻人症和淀粉样变心肌病等。临床病理检测发现,此类疾病患者的病灶处通常存在多种致病蛋白的沉积。例如,淀粉样变心肌病患者的心脏组织中,同时存在转甲状腺素蛋白(transthyretin,TTR)、载脂蛋白和血清淀粉样蛋白A等多种蛋白质共沉积的现象。通过发展化学生物学工具同时观测多种蛋白质共聚集过程,可帮助在多致病因子所导致的蛋白质构型疾病中找出致病蛋白质。
合作团队基于前期相变蛋白质荧光探针的研究基础(Anal. Chem., 2021;Angew. Chem. Int. Ed., 2021;Angew. Chem. Int. Ed., 2021),进一步开发了具有不同发射光谱的荧光探针,用于实时追踪蛋白质的聚集过程。研究发现,扩大探针光谱覆盖范围,可避免荧光信号之间的相互干扰,将现有商用单色荧光热迁移分析法拓展为双色双通道。该方法可同时追踪两种不同蛋白质的聚集过程,并定量研究它们在共聚集过程中的热力学稳定性的变化。利用该方法,团队量化了杂合模型蛋白系统中蛋白聚集临界温度的变化,揭示了野生型TTR的热力学稳定性受突变型蛋白显著影响。团队利用该方法证明了小分子药物对不同蛋白质聚集过程具有选择性抑制作用。此外,团队还研究了这种方法在活细胞中如何检测目标蛋白质的共沉积过程中,并解析其相互作用机制。该工作利用新型化学生物学研究工具,实现了对蛋白质共沉淀过程中多种蛋白质相互作用的研究与分析,为复杂的疾病机理研究提供了可行方法。
上述成果于近日以题为“Quantitative Interrogation of Protein Co-aggregation using Multi-color Fluorogenic Protein Aggregation Sensors”发表在《化学科学》(Chemical Science)上。该工作的第一作者是我所02T5组2018级博士研究生白玉龙。该工作得到国家自然科学基金、辉瑞公司ASPIRE award for transthyretin amyloidosis basic research、辽宁省兴辽人才计划、大连市科创基金、博士后面上基金等项目的资助。(文/图 白玉龙)






