近日,我所生物分子结构表征新方法创新特区研究组(18T5组)王方军研究员团队在超大分子量膜蛋白质复合物组成和结构动态分析方面取得新进展,通过整合化学交联质谱法和整体蛋白质组学分析,解析出光系统II复合物的动态光损伤分子机制。
光系统II(PSII)是光合作用过程中光依赖性反应中的第一膜蛋白复合物,是催化水的氧化产生氧气的核心。PSII复合物主要以二聚体形式嵌入类囊体膜中,每个单体含有20多种不同的蛋白质亚基,二聚体总分子量约为700kDa。虽然光是光合作用的能量来源,但是过量的光照也会造成光损伤。PSII是光损伤的关键部位,光损伤导致复合物中电子传递链失活,并造成复合物放氧活性中心的氧化损伤和放氧活性丧失。由于PSII二聚体分子量巨大,对其在光损伤过程中的组成和结构变化的动态分析极具挑战。
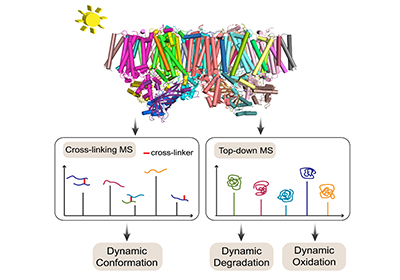
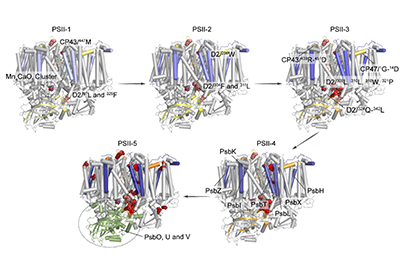
为对PSII膜蛋白复合物在光损伤过程中的组成、结构和氧化修饰变化进行全面分析,王方军团队提出了化学交联质谱法和整体蛋白质组学分析整合策略,发现这两种分析方法获得的结果高度互补、相互验证。研究显示,在光损伤早期,PSII核心蛋白亚基靠近锰簇的氨基酸残基如D2/304F和311L发生氧化,同时锰簇附近的序列区域如D2/324Q-342L首先被降解。随后,复合物电子传递链中PheoD2,QA,非血红素铁以及CP47和CP43的基质侧附近残基发生氧化,核心蛋白亚基D1,D2,CP47和CP43中发生了明显的降解和解离,外周小亚基也发生降解并最终从核心亚基上解离。研究还发现,囊腔侧结构域的主要部分在光照过程中相对稳定,并且在核心亚基降解后可能与复合物整体完全脱离。该工作对PSII膜蛋白复合物的光损伤分子机制进行了全面解析,加深了对光损伤过程的认识。
该工作于近日发表在中国化学会旗舰刊物CCS Chemistry上。该工作得到国家自然科学基金、辽宁省自然科学基金、我所科研创新基金等项目的资助。(文/图 周烨)






