近日,我所复杂分子体系反应动力学研究组(1101组)韩克利研究员和生物分子功能与机制研究组(1821组)朴海龙研究员,与深圳晶泰科技有限公司(XtalPi)团队合作,发现谷胱甘肽转移酶(GST)荧光探针分子的整体识别性能除了受控于传统意义上的识别基团,还与荧光团的缺电子性密切相关。
GST是一种重要的II期解毒酶,通过催化谷胱甘肽(GSH)亲核进攻并加合到目标物的亲电中心,增加其亲水性以便于运输和排出细胞外,从而达到解毒的目的。相比于正常组织和细胞,GST在多种癌症中的过表达,成为一种重要的多药抗性癌症标记物。近红外荧光探针因其高穿透性、低背景荧光、便于活体成像等优点而更具实用价值,然而文献中对检测GST的该类探针鲜有报道和研究。
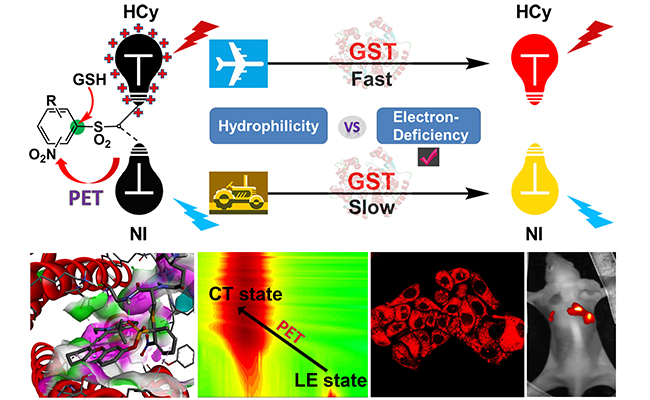
研究团队在前期工作(Research, 2020)的基础上,在保持系列识别基团不变的前提下,通过引入带正电荷的近红外菁类荧光团HCy以替换先前的双光子荧光团NI,发现HCy系列探针均比相应的NI系列探针有显著更强的非酶促和酶促反应性。从实验和理论计算两个层面对该研究及相关文献中的反应动力学结果进行了详实的分析推理论证后,研究人员得出结论:上述现象源于荧光团更强的缺电子性而非亲水性。由此导致HCy系列探针中兼具高灵敏度和低背景反应噪音的实用探针为识别基团亲电性更弱的HCy2(对位取代基为三氟甲基)和HCy9(对位为氢原子),这与对位取代基为氰基的NI3形成了鲜明对比,也打破了其它文献中人们对氰基的固有依赖。同时,在此现象的“信号放大”效应下,识别基团之间反应性差异导致的其对不同亚型同工酶的选择性区别得以显现,该实验结论得到了分子对接模拟结果的印证。进一步在细胞、组织及模式小鼠活体成像中的结果验证了HCy2和HCy9检测GST的实用性。此外,尽管普遍认为不易通过光致电子转移(PET)调控近红外探针的荧光传感,该工作通过超快光谱和量化计算证明HCy系列探针的传感机理确为PET,且识别基团的亲电性也会反过来影响荧光传感效率。该研究为荧光探针的整体设计观提供了启示和借鉴。
上述研究成果发表在《化学科学》(Chemical Science)上。相关工作得到了国家自然科学基金和国家重点研发计划等项目的资助。(文/图 张学祥)






