近日,我所生物分离分析新材料与新技术研究组(1809组)叶明亮、邹汉法研究员等人在复杂体系酶与底物相互作用的酶促动力学研究取得进展。相关研究成果以Correspondence的形式发表在最新一期的Nature Methods上(Nature Methods, 2014, 11,220-222)。
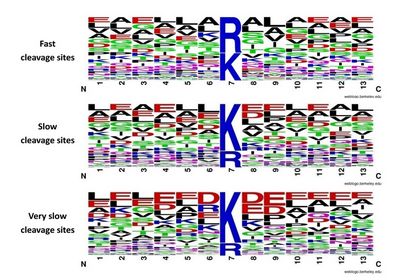
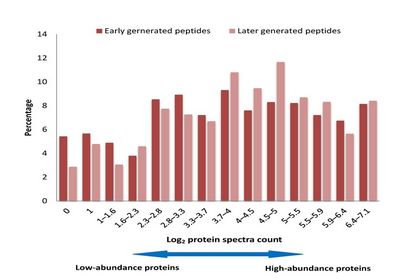
蛋白酶是蛋白质组学研究的工具酶,利用蛋白酶可以将复杂蛋白质组样品中的蛋白质酶解成肽段而实现通量化的蛋白质分析鉴定。在复杂蛋白质组样品中存在数以十万计的不同蛋白质,它们的丰度相差很大,有些甚至相差十几个数量级。很多科研人员认为高丰度蛋白质由于其浓度高而具有更高的反应速度,因此将首先被酶解。为了研究蛋白质的酶解速度与其丰度的关系,叶明亮等人利用定量蛋白质组学技术研究了胰蛋白质酶酶解复杂蛋白质样品的动力学,通过定量比较酶解的两个时间点产生的肽段,获得了酶解的动态数据。研究结果表明:(1)具有不同酶解速率的酶切位点与其周围的氨基酸残基有关,周围残基是中性的则酶解比较快,而周围残基是带电的则酶解比较慢;(2)肽段的酶解速率与蛋白质的丰度没有明显的相关性,说明高丰度蛋白质并没有被先酶解。这一研究结果表明在复杂蛋白质组样品的酶解过程中,各个蛋白质的酶解速度(消耗速度)主要与该蛋白质酶切位点的数量和动力学特点有关,而与其丰度基本无关。
在蛋白质组学研究中,蛋白质的酶解、修饰酶的底物筛选等都涉及酶与大量的、丰度不同的底物的酶促反应。该工作开创了利用定量蛋白质组技术研究复杂体系中酶促动力学的先河,将对完善米氏方程为基础的酶促动力学理论研究起到促进作用。(文/图 叶明亮)